Окисление аммиака
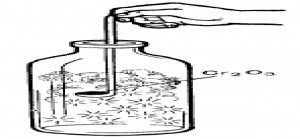 Катализ всегда вызывает удивление. Этот опыт — очень красивое зрелище. Возьмите для попытки большой сосуд из прозрачного стекла, например, бутыль или колбу 10-20 л. Налейте в сосуд раствора аммиака столько, чтобы после взбалтывания жидкость покрывала только ее дно. Внесите в сосуд в железной ложечке мелкий, хорошо нагретый катализатор — оксид хрома (III) (рис.). Через 1-2 мин начинайте рассыпать катализатор. Образуется сноп искр ‒ раскаленных мелких частиц оксида хрома (III), которые причудливо двигаются внутри сосуда. (Попытку лучше всего проводить в затемненном помещении). Через некоторое время содержимое сосуда окрашивается в бурый цвет. Сначала происходит каталитическая реакция окисления аммиака по уравнению:
Катализ всегда вызывает удивление. Этот опыт — очень красивое зрелище. Возьмите для попытки большой сосуд из прозрачного стекла, например, бутыль или колбу 10-20 л. Налейте в сосуд раствора аммиака столько, чтобы после взбалтывания жидкость покрывала только ее дно. Внесите в сосуд в железной ложечке мелкий, хорошо нагретый катализатор — оксид хрома (III) (рис.). Через 1-2 мин начинайте рассыпать катализатор. Образуется сноп искр ‒ раскаленных мелких частиц оксида хрома (III), которые причудливо двигаются внутри сосуда. (Попытку лучше всего проводить в затемненном помещении). Через некоторое время содержимое сосуда окрашивается в бурый цвет. Сначала происходит каталитическая реакция окисления аммиака по уравнению:
4NH3 + 5O2 = 4NO + 6H2O
Затем окисляется оксид азота по уравнению:
2NO + O2 = 2NO2.
Если взять избыток аммиака, сосуд заполнится белым дымом. Происходят следующие процессы:
3NO2 + H2O = 2HNO3 + NO,
NH3 + HNO3 = NH4NO3.
Для проведения опыта большое значение имеет количество оксида хрома, нагрев катализатора, продолжительность взаимодействия, количество гидроксида аммония.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.