Химическая кинетика
Кинетика химических реакций — часть физической химии, которая изучает закономерности протекания химических реакций, влияние концентрации веществ, температуры и других причин на скорость реакции.
А. Налейте в пробирку 2 мл уксусной кислоты (80%-ный раствор). Опустите в нее несколько кусочков цинка, предварительно очистив их в пробирке с соляной кислотой и промыв водой. Пузырьки водорода выделяются слабо. Добавьте немного воды — реакция пойдет быстрее.
С увеличением содержания воды возрастает степень диссоциации уксусной кислоты. Если -добавить большое количество воды, то реакция замедлится. Быстрее всего цинк реагирует с 15%-ной уксусной кислотой.
Б. Нанесите на стекло по 1 капле раствора карбоната натрия, воды и серной кислоты. Стеклянной палочкой соедините растворы. Через некоторое время приблизительно посередине капли воды начнет выделяться углекислый газ.
Ионы, образующиеся при диссоциации карбоната натрия и кислоты, чтобы провзаимодействовать, должны встретиться. Они постоянно движутся, диффундируют в капле воды, и газ выделяется вдоль границы, разделяющей область диффузии соды и кислоты.
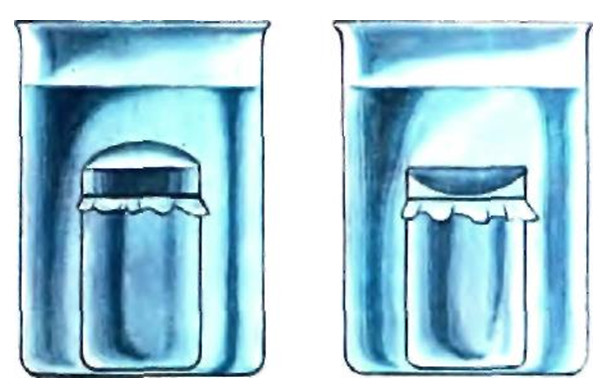
В. Приготовьте раствор сахара в воде, влейте его в малый стакан, воду — в большой. Соберите прибор, как показано на рисунке. Во втором приборе раствор и воду поменяйте местами. На малые стаканы привяжите сверху целлофановую пленку, предварительно смоченную в воде. Через некоторое время в первом приборе пленка выгнется, а во втором — вогнется внутрь.
Рис. Диффузия молекул воды через полупроницаемую пленку
Опыт демонстрирует природный важный процесс, происходящий в живых клетках растений и животных, осмос. В первом приборе концентрация молекул воды в малом стакане меньше, чем в большом, поэтому эти молекулы диффундируют из большого стакана через полупроницаемую целлофановую пленку. Объем раствора в малом стакане возрастает. Во втором приборе протекает обратная диффузия. Это явление впервые заметил и описал еще в середине прошлого века химик Т. Грем.
Г. Для демонстрации закономерности диффузии газов возьмите стеклянную трубку длиной 60 см и диаметром 1 см. Оба конца закройте ватками, смоченными растворами соляной кислоты и аммиака. Через некоторое время вблизи ватки, смоченной соляной кислотой, возникнет белое кольцо.
Молекулы аммиака меньше молекул хлороводорода, поэтому они быстрее диффундируют через воздух и реакция идет вблизи ватки, смоченной соляной кислотой;
NН3 + НС1 = NH4С1.
Д. На скорость протекания химической реакции большое влияние оказывает величина поверхности реагирующих веществ. Разотрите мел в ступке. В таком виде он гораздо быстрее растворится в соляной кислоте.
Известно, что пирофорные металлы гораздо быстрее окисляются кислородом воздуха, чем металлы в виде больших кусков, имеющих меньшую поверхность. В этом легко убедиться, проделав опыт. В три пробирки с одинаковыми навесками медной пленки, порошка, приготовленного из проволоки с помощью напильника, и проволоки меди налейте равные объемы азотной кислоты одинаковой концентрации. В первой пробирке наблюдается значительно большая скорость реакции, о чем можно судить по быстрому исчезновению пленки. Это связано с тем, что величина поверхности пленки больше, чем у порошка и проволоки меди.
Е. Для выяснения особенностей взаимодействия двух твердых веществ разотрите в ступке таблетку фенолфталеина и добавьте несколько гранул твердой щелочи. Если смесь сухая, реакция не происходит. Разотрите смесь пестиком, при этом она окрасится в малиновый цвет. Добавьте в ступку воды — появится интенсивная окраска.
Скорость различных реакций между твердыми веществами не одинакова. В,этом можно убедиться на опыте. Засыпьте роданид аммония и сульфат кобальта (II) в пробирку слоями. Через несколько минут между слоями реагентов появляется тонкая синяя полоска продукта реакции — роданида кобальта. Если для опыта взять йодид калия и ацетат свинца (II), желтая полоска йодида свинца (II) появится через несколько дней.
Влияние температуры на скорость химической реакции можно наблюдать на следующем опыте. В три пробирки с осажденной пленкой меди примерно одинаковой массы налейте 1-молярный раствор азотной кислоты, нагретый до 40, 60 и 80 °С. Чем выше температура кислоты, тем быстрее протекает реакция растворения меди.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.