Еще о кристаллизации
При нагревании растворимость многих солей увеличивается. Если приготовить насыщенный раствор такой соли в воде, а затем охладить его, то часть солеи выпадет в осадок, причем в нем будет меньше примесей, чем в растворе. Однако обычный хлорид натрия — исключение из этого правила. Его растворимость в воде почти не изменяется с увеличением температуры, поэтому соль трудно перекристаллизовать обычным способом.
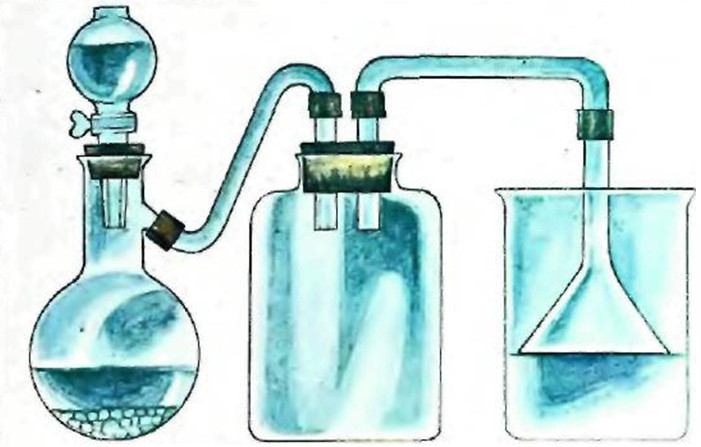
Приготовьте в стакане при комнатной температуре насыщенный раствор хлорида натрия. Отфильтруйте раствор и перелейте в другой стакан, охлаждая в течение всего опыта льдом (опыт проводите под тягой!). Соберите прибор, как показано на рисунке.
Рис. Получение кристаллов хлорида натрия.
Из прибора для получения газов введите в охлажденный раствор соли хлороводород. Через несколько минут на стенках стакана появятся кристаллики хлорида натрия. По мере пропускания газа они будут расти.
Уравнение диссоциации хлорида натрия:
NaCl ↔ Na+ + Cl—.
Чтобы получить кристаллы хлорида натрия, надо уменьшить его растворимость. Исходя из принципа Ле-Шателье, в раствор для уменьшения растворимости хлорида натрия надо добавить какой-нибудь одноименный ион (Na+ или С1—). Ввести одноименный ион можно только с таким веществом, которое не вызовет загрязнения. Таким соединением и является хлороводород, диссоциирующий в воде на ионы Н+ и С1—. Равновесие реакции сдвигается влево, выпадает чистый хлорид натрия.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.