Кристалофосфоры
Для изготовления люминофора временного действия берут чистый карбонат кальция или углекислые соли бария, стронция или кадмия и смешивают с таким же количеством химически чистой серы («серный цвет»). Общий вес смеси 50-80 г. Смесь обливают спиртовым раствором нитрата висмута (3-5 мл раствора из расчета ‒ 0,01 г Ві(NO3)3 на 5 л воды). Массу хорошо перемешивают, помещают в обмазанный глиной фарфоровый тигель с крышкой и ставят в муфельную печь или, укутав сверху и по бокам асбестом, ‒ на обычную электрическую печь на 3-4 часа. Медленно охлажденный в тигле и затем растертый люминофор высыпают в сухую пробирку, которую хорошо закрывают пробкой и заливают сургучом, чтобы туда не попала влага.
После освещения обычной электрической лампой (лучше люминисцентной) люминофор светится в течение 10 мин. красивым голубым светом. После нового освещения свечение опять повторяется, если за активатор взять нитрат меди Сu(NO3)2 или аргентум нитрата АgNO3, то свечение люминофора будет синего цвета. Когда за основу взять карбонатные соли цинка или кадмия, а активатором будет Сu(NO3)2, люминофор светиться в течение часа золотистым цветом.
Реакции происходят так:
CaCO3 + S = CaS + CO2
SrCO3 + S = SrS + CO2
CdCO3 + S = CdS + CO2
ZnCO3 + S = ZnS + CO2
Сера частично выгорает.
Как видно, главной составной частью таких красок является сернистые соли Все вещества, входящие в состав светящихся красок, должны быть химически чистыми. Изготовление таких красок требует очень большой аккуратности. При составлении рецептов смесей красок надо придерживаться обязательной последовательности: сначала соли смешивают с крахмалом, затем смесь подсушивают; сухую смесь смешивают с серой и окислами, хорошо растирая в фарфоровом тигле; прокаливают; охлажденную смесь растирают в ступке и просеивают через густое сито.
Для покрытия деталей порошки красок разводят на специальных лаковых основах. Разведенную краску надо наносить сразу и на специально обработанное лаком или масляной краской место мягкой кисточкой или гусиным пером. Консистенция краски должна быть такой, чтобы она медленно стекала с кисточки. Светящиеся краски боятся влаги. Время свечения их ограничено.
Ниже приведен перечень заводских рецептов изготовления светящихся красок.
Ярко-красный цвет
Карбоната бария …………………………20 г
Серы …………………………………………..3 г
Сахара ………………………………………..1 г
Фосфорнолитийовой соли …………..0,5 г
Нитрата меди ……………………………..1 мл
Нитрата рубидия ………………………..1 г
Розово-красный цвет
Карбоната бария ………………………..20 г
Серы …………………………………………..3 г
Сахара ………………………………………..1 г
Буры ………………………………………….0,1 г
Сульфата натрия ………………………..0,3 г
Фосфорнолитийовой соли …………..0,3 г
Нитрата меди …………………………….0,5 мл
Фиолетово-синий цвет (длительного свечения)
Оксида кальция …………………………..40 г
Серы ……………………………………………6 г
Карбоната лития ………………………….2 г
Крахмала …………………………………….2 г
Сульфата калия ……………………………1 г
Водно-спиртового раствора
нитрата висмута …………………………..2 мл
Водно-спиртового раствора
нитрата тантала ……………………………2 г
Домаровый лак
Домаровой смолы ……………………….52 г
Ксилола ……………………………………..43 г
Касторового масла ……………………..5 г
Смолу заливают ксилолом и хорошо перемешивают. После растворения смолы добавляют касторовое масло. Образованную смесь фильтруют через замшу, и лак приобретает соломенно-желтого цвета.
Светящуюся краску (2,5 г) растворяют в домаровому лаке (1 г), смесь хорошо растирают и перемешивают, чтобы предотвратить образование комочков и расслоению массы.
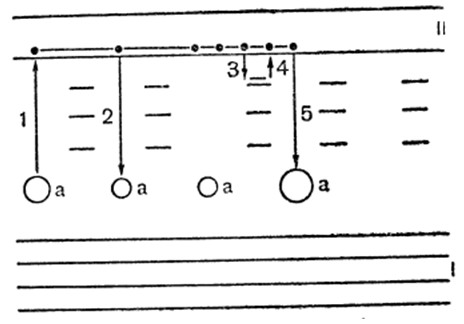
Свечение кристалофосфоров можно объяснить процессом, который происходит не всегда одинаково (рис.).
Рис. Схема электронных переходов в кристалофосфорах
При возбуждении внутри кристалла образуются свободные электрические заряды. Электроны чаще отрываются от активатора, активатор ионизируется, и внутри кристалла появляются ионизированные центры. Оторванный электрон переходит (переход 1) в так называемую полосу проводимости ІІ. Здесь он имеет возможность свободно передвигаться внутри кристаллической структуры. Двигаясь внутри кристалла, электрон встречается с другим ионом активатора, соединяясь с ним (переход 2). При этом, как показали опыты, возникает свечение. Движение электронов по полосе проводимости внутри кристаллической структуры происходит с большой скоростью, а потому соединения электронов с ионами активатора также происходит очень быстро. Рекомбинация всех выделенных электронов с ионизированными центрами происходит в течение долей секунды.
Однако на практике, кроме краткосрочного свечения, наблюдается и длительное (от минут до нескольких часов), это дает право говорить, что электрон, который выделился при возбуждении, не сразу соединяется с ионизированными центрами, а где-то на пути задерживается внутри кристаллической структуры. Об этом процессе свидетельствуют места захвата, которые образуются в местах дефектов кристаллической структуры (поблизости от мест размещения ионов активатора); Подробно изучение этого процесса выявило, что внутри кристалла могут существовать различные системы мест захвата, которые различаются тем, удерживающие электроны, попавшие в них, с большей или меньшей силой. На схеме места захвата обозначены отдельными горизонтальными черточками, переход электрона из полосы проводимости к месту захвата обозначено вертикальной линией, и чем ниже размещена риска, тем больше энергия нужна для переноса электрона с места захвата в полосу проводимости.
Освобождение локализованных электронов может происходить различными путями. В некоторых случаях оно становится результатом тепловой энергии кристаллической структуры. Так освобождаются электроны с малых уровней, слабо связанных в местах захвата. Наиболее сильно связаны электроны из самых глубоких уровней могут быть освобождены только при поглощении захваченными электронами больших порций энергии, происходящее при освещении возбужденных кристалофосфоров светом.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.