Электролиз
Процесс электролиза широко используется в промышленности. В небольших масштабах его можно воспроизвести в лаборатории.
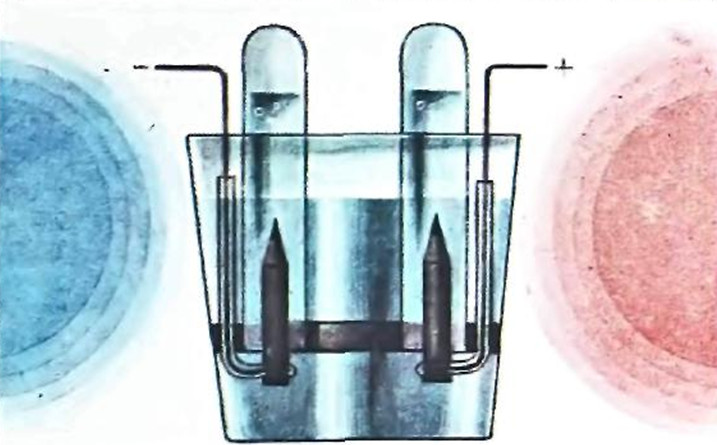
А. Электролитической ванной будет служить стакан Поместите в него фанерный кружок, в котором по диаметру сделана прорезь, а по обе стороны от прорези проколоты шилом два отверстия, через которые будут проходить проволоки. В прорези вставьте два карандаша длиною 5 см, очинённых с одного конца. На неочиненных концах карандашей сделайте зарубки, чтобы обнажились грифели, на которые намотайте проволоку. Тщательно обмотайте проволоку изоляционной лентой и для лучшей изоляции наденьте на нее резиновые трубки (рис. 1).
Рис. 1. Электролиз раствора карбоната натрия
Налейте в стакан раствор карбоната натрия. Пробирку также заполните этим раствором, закройте ее большим пальцем, переверните вверх дном, погрузите в стакан, чтобы воздух не попал в пробирку, и под водой наденьте на электрод. Включите последовательно три батарейки от карманного фонарика и начните электролиз. При этом вода будет разлагаться:
2Н2O = 2Н2 + O2.
Когда на катоде соберется полная пробирка водорода, достаньте ее и подожгите газ. Он сгорит с характерным звуком. Можно доказать, что пробирка на аноде заполнена кислородом.
Этот же прибор можно использовать и для проведения электролиза раствора хлорида натрия. При этом одна пробирка заполнится водородом, а в другой соберется газ желто-зеленого цвета — хлор. Пробирку с хлором закройте пальцем под водой и встряхните. При этом образуется раствор хлора — хлорная вода. Она может обесцвечивать растворы восстановителей, например чернил.
Ионы галогенов при электролизе движутся к аноду и образуют на нем молекулы галогенов. Ионы натрия Na+ остаются в растворе, образуя около катода щелочь, в чем легко убедиться, прибавив фенолфталеин в катодное пространство.
Б. Докажите, что в зависимости от материала электродов при электролизе могут образовываться различные продукты. В приборе, описанном в предыдущем опыте, замените карандаши на железные электроды (например, на два гвоздя). Проведите электролиз насыщенного раствора хлорида натрия. На катоде будет выделяться водород. В области анода образуются зеленоватые или красно-бурые хлопья. Это гидроксид железа (II) и гидроксид железа (III):
Fе2+ + 2OН— = Fе(ОН)2↓;
Fе3+ + 3ОН— = Fе(ОН)3↓.
Анод при этом растворяется и становится значительно тоньше, чем катод. Гидроксид железа (II) легко окисляется растворимым в воде кислородом воздуха:
4Fе(ОН)2 + O2 + 2Н2O = 4Fе(ОН)3↓.
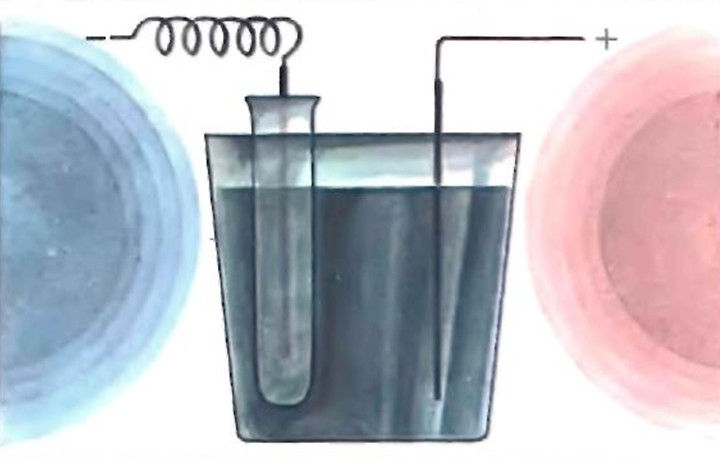
В. Электролитически можно проводить синтезы различных веществ. Так как для проведения этих опытов необходимо напряжение 5-7 В, то понадобятся пять последовательно соединенных батареек от карманного фонарика и сопротивление. Его можно изготовить, распрямив нихромовую спираль от электроплитки и намотав 5 см на деревянный стержень так, чтобы витки не соприкасались. Для опытов понадобится пористая диафрагма. Ее можно сделать в виде пробирки из полихлорвинилового тюбика из-под синтетического клея, обрезав ножницами верх, либо из полихлорвиниловой трубки. В качестве электролитической ванны можно использовать стакан, а электродов — куски медной проволоки.
Для получения хлорида меди соберите прибор, как показано на рисунке 2. Приготовьте электролит (1 %-ный раствор соляной кислоты). В стакан и пористую диафрагму налейте 100 мл этого раствора, опустите медный электрод в диафрагму и соедините его с катодом батарейки через сопротивление. Пропускайте ток до тех пор, пока раствор в стакане не станет темно-зеленым.
Рис. 2. Получение хлорида меди в процессе электролиза
Ионы меди не достигают катода под действием тока, так как их не пропускает пористая диафрагма, они остаются в растворе. На катоде разряжаются ионы водорода:
2Н+ + 2e— = Н2↑.
Выпарите раствор, вы получите сухую соль меди.
Для получения оксида меди соберите такой же прибор, но без пористой пробирки. Приготовьте электролит (10%-ный раствор хлорида натрия). Электролиз продолжайте до тех пор, пока содержимое стакана не превратится в густую пасту. Процесс ведите при перемешивании. Гидроксид-ионы, образующиеся у катода, взаимодействуют с ионами меди, поступающими с анода:
Сu2+ + 2OН— = Сu(ОН)2↓.
Если осадок гидроксида меди промыть .водой и нагреть в чашке, то получится оксид меди (II):
Сu(ОН)2 = СuО + Н2O.
Г. Проведите электролиз нитрата серебра (можно использовать ляпис). Электродами будут служить две медные проволоки, зачищенные наждачной шкуркой и промытые ацетоном. Наконечники от 2-3 ляписных карандашей поместите в пробирку и нагрейте до 200 °С. Образуется раствор, содержащий ионы Аg+, К+, NO3—. Присоедините электроды к пяти последовательно соединенным батарейкам и введите в расплав. На катоде начнет выделяться серебро:
Ag+ + e— = Ag
На аноде выделяется кислород и оксид азота (IV) (бурый газ). Возле анода расплав будет синеть — растворяется медный анод.
Д. Получите гексахлорстаннат (IV) аммония (NН4)2SnС16. В фарфоровую чашку налейте 10 мл раствора НС1 (1:1). Анод из металлического олова и катод из гвоздя подключите к двум последовательно соединенным батарейкам. При подключении тока оловянный анод растворяется и образуются ионы олова, на катоде выделяется водород. Через час слейте раствор в другую фарфоровую чашку, добавьте 0,5 г хлорида аммония и охладите в холодильнике. При охлаждении выпадает осадок (NН4)2SnС16.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.