Установить строение с помощью рассуждений
Довольно часто химики сочетают эксперимент с последующим, а иногда, что особенно интересно, с предварительным рассуждением. Разберем это на примере тех логических построений, которые использовал швейцарский химик Артур Вернер при создании координационной теории.
Известна чувствительная качественная реакция, которая позволяет обнаружить ион хлора в водном растворе, это реакция с нитратом серебра. При этом мгновенно выпадает белый осадок хлорида серебра. По количеству образовавшегося хлорида серебра можно точно определить количество ионов хлора в растворе. Это было проверено на большом числе неорганических хлоридов. Теперь перейдем к комплексным соединениям. Возьмем три известных комплексных соединения хлорида трехвалентного кобальта с аммиаком, в них к хлориду кобальта присоединено различное число молекул аммиака:
CoCl3∙6NH3, CoCl3∙5NH3, CoCl3∙4NH3
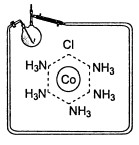
Из раствора первого соединения Аргентум нитрат осаждает (в виде АgС1) три атома хлора, из второго соединения только два атома хлора, а из третьего всего один. Какой вывод можно сделать из этих наблюдений? Ионы хлора в первом соединении одинаковы, они подобны ионам хлора в хлориде натрия и легко осаждаются в виде хлорида серебра. А вот во втором и третьем соединениях есть еще какой-то иной тип ионов хлора. Артур Вернер предположил, что вокруг атома металла имеется координационная сфера, которая прочно удерживает находящиеся в этой сфере ионы или молекулы. Обозначив координационную сферу скобками, мы можем представить все три комплексных соединения кобальта следующим образом:
[Co(NH3)6]Cl3, [CoCl(NH3)5]Cl2, [CoCl2(NH3)4]Cl
Именно те ионы хлора, которые находятся вне координационной сферы (вне квадратных скобок), реакционноспособны, т. е. взаимодействуют с нитратом серебра. Выделение координационной сферы скобками оказалось не только удобным, но и плодотворным. Обратите внимание, суммарное число ионов хлора и молекул аммиака внутри квадратных скобок всюду одинаково. Оно равно шести. Эта величина получила название координационного числа. Координационное число для большинства ионов металлов сохраняется неизменным или варьирует в небольших пределах. Молекулы и ионы, входящие в координационную сферу, получили название лигандов. Подробнее о координационных соединениях можно узнать из учебников, наша задача заключается в том, чтобы посмотреть, как сочетание рассуждений и результатов опыта может привести к выяснению структуры.
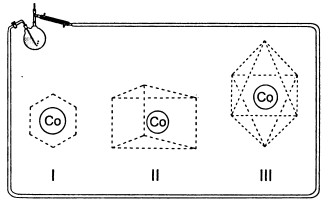
Итак, мы имеем шестикоординированный атом кобальта, в координационной сфере два типа лигандов — ионы хлора и молекулы аммиака, меняется только их количественное соотношение. Отвлечемся на время от химии и используем наше пространственное воображение. Как же расположены лиганды вокруг атома металла? Первое предположение Вернера состояло в том, что лиганды расположены симметрично. Почему? Здесь свою роль сыграла интуиция химика, умноженная на большой опыт, который подсказывает, что.в кристаллических соединениях природа предпочитает симметрию. Какие же симметричные структуры с шестью вершинами существуют? Известны плоская (I), призматическая (ІІ) и октаэдрическая структура (III):
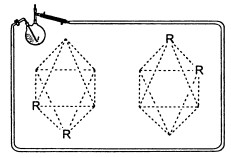
Объемные структуры II и III на рисунках несколько искажены для более удобного рассматривания. На самом деле в основаниях призмы II лежат правильные треугольники, боковые грани — квадраты, все грани октаэдра III — правильные треугольники. Теперь вспомним о понятии «изомеры», которое уже упоминалось нами при обсуждении строения бензола. В пространственных структурах, представляющих собой многогранники, тоже могут быть изомеры, их чаще называют стереоизомерами. Отличать стереоизомеры друг от друга не всегда просто. Когда необходимо решить вопрос, представляют ли собой две структуры изомеры или это одно и то же соединение, помогает удобное правило: если одна структура в результате перемещений и поворотов может полностью совпасть в пространстве с другой, то это одно и то же соединение. Например, структуры, изображенные на рисунке:
можно точно совместить в пространстве, повернув предварительно одну из них вокруг вертикальной и горизонтальной оси. Следовательно, это не изомеры, а одно и то же соединение.
Теперь попробуем написать все возможные изомеры для плоской шестиугольной структуры с двумя типами лигандов, С1 и NH3. В рассмотрение будем брать только координационную сферу — т. е. то, что находится в квадратных скобках. Соединение [СоС1(NH3)5]Сl2 может существовать в виде только одного изомера:
Можно поменять местами атом хлора с любой молекулой аммиака, но новых изомеров мы при этом не получим.
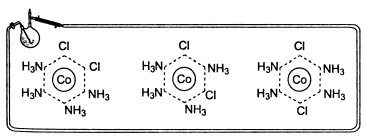
Для соединения [СоСl2(NН3)4]С1 возможны три изомера (атомы хлора находятся по соседству, через одну молекулу аммиака и через две):
У соединения [СоС13(NН3)3] также существуют только три изомера:
Перейдем к призматической структуре II и проделаем все эти построения для тех же трех комплексных соединений кобальта. Для соединения [СоС1(NН3)5]С12 возможен только один изомер:
Здесь необходимо пояснить, что пунктирные линии не обозначают химические связи. Это лишь способ объемного изображения воображаемого каркаса, в вершинах которого находятся лиганды. Природу химической связи центрального атома металла с окружающими лигандами мы здесь не рассматриваем. Нас интересует логический вывод, который мы можем сделать, перебирая все варианты заполнения координационной сферы.
Продолжим наши построения. Для соединения [СоСl2(NН3)4]С1 возможны три изомера:
У соединения [СoCl3(NН3)3] существуют тоже три изомера:
Вероятно, вам кажется, что здесь показаны не все возможные варианты. Попробуйте сами расположить как-либо иначе три атома хлора и три молекулы аммиака на вершинах этой призмы. Вы будете все время получать один из трех показанных здесь вариантов, при этом некоторые ваши структуры будут перевернуты «вверх ногами». Чтобы выяснить, изомерны сравниваемые структуры или это одно и то же соединение, надо лишь применить то правило, о котором мы говорили чуть ранее: следует их мысленно повернуть подходящим образом в пространстве и затем соединить, вкладывая одну в другую, как нож в ножны. Вы убедитесь, что новых стереоизомеров у вас не получится.
Теперь за основу возьмем октаэдрическую структуру III. Для соединения [СоС1(NН3)5]С12 возможен только один изомер:
Эта процедура несколько напоминает произвольное развешивание определенного числа разноцветных шаров на новогодней елке.
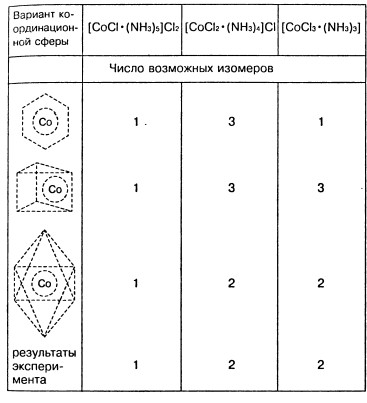
Теперь все полученные нами варианты представим в виде таблицы, где объединим соотношения изомеров для различных вариантов координационной сферы. Самое интересное — последняя строка таблицы, в ней показано соотношение изомеров, полученное не в результате рассуждений, а опытным путем.
Осталось сравнить последовательность «один — два — два», полученную экспериментально (последняя строка таблицы), с последовательностями, расположенными в верхней части таблицы. Мы видим, что совпадение есть только с одной, т. е. с третьей «теоретической» строкой. Следовательно, координационная сфера имеет конфигурацию октаэдра. Таким образом, строение соединений удалось установить, сочетая эксперимент с простыми логическими рассуждениями. Правильность полученного вывода была подтверждена много позже с помощью рентгеноструктурного анализа.
А если бы результаты эксперимента совпали не с третьей, а с первой или второй строкой (они же одинаковы)? В этом случае потребовались бы некоторые дополнительные рассуждения и эксперименты, но можно не сомневаться, что Вернер сумел бы решить и эту задачу.
Все рассмотренные нами «логические упражнения» с комплексами кобальта стали одним из кирпичиков, положенных А. Вернером в фундамент координационной теории. В 1915 г. за создание этой теории Альфред Вернер получил Нобелевскую премию.
Отзывов (2) на «Установить строение с помощью рассуждений»
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
![[СоС13(NН3)3] [СоС13(NН3)3]](http://khimie.ru/wp-content/uploads/2011/12/SoS13NN33.jpg)
![[СоС1(NН3)5]С12 [СоС1(NН3)5]С12](http://khimie.ru/wp-content/uploads/2011/12/SoS1NN35S12.jpg)
![[СоСl2(NН3)4]С1 [СоСl2(NН3)4]С1](http://khimie.ru/wp-content/uploads/2011/12/SoSl2NN34S1.jpg)
![[СoCl3(NН3)3] [СoCl3(NН3)3]](http://khimie.ru/wp-content/uploads/2011/12/SoCl3NN33.jpg)
![[СоС1(NН3)5]С12 [СоС1(NН3)5]С12](http://khimie.ru/wp-content/uploads/2011/12/SoS1NN35S121.jpg)
18 Дек 2011 в 20:44
Наверное очень важная теория была для своего времени, раз дали Нобелевскую премию
20 Дек 2011 в 10:57
Интересное построение теории на предварительных рассуждениях…Трудно даже представить! Нужно быть ученым как Артур Вернер…