Когда возбуждаются атомы
Всего двух примеров, связанных с исследованием состава дроби и оплавленного металла, достаточно, чтобы оценить ту большую помощь, которую оказывает экспертам метод атомно-эмиссионной спектрометрии при идентификации вещественных доказательств. Принцип идентификации в данных случаях основан на сравнении состава металлических предметов. Атомно-эмиссионная спектрометрия применяется как метод элементного анализа вещества. Принципиально метод основан на том, что измеряются спектры испускания (разность энергии электронов на энергетических уровнях, расположенных на периферии атома, то есть валентных электронов). Поскольку эти величины характеристические для каждого элемента, по положению линий в эмиссионных спектрах можно судить о составе исследуемого вещества.
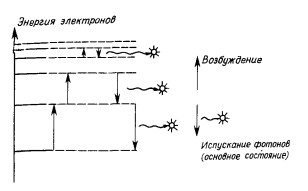
Известно, что при нагревании тела скорость перемещения (диффузия) отдельных компонентов увеличивается. По мере увеличения температуры твердого тела прежде всего разрушается кристаллическая решетка, затем вещество переходит в жидкое состояние и в конце концов происходит испарение (переход в пар). Что же произойдет при дальнейшем повышении температуры? Представим себе, что танцевальные пары в переполненном зале вынуждены двигаться все быстрее и быстрее; столкновения станут неизбежны со всеми вытекающими последствиями. В паровой фазе также при нагревании, то есть при поступлении дополнительной энергии, молекулы вынуждены разрушаться, то есть диссоциировать на отдельные атомы. Энергию, сообщаемую атомам при многократных соударениях, прежде всего воспримут электроны, расположенные на внешних оболочках, то есть валентные электроны. Допустим, что после очередного удара валентный электрон поглощает дополнительную энергию. Если последняя достаточна для перехода электрона на незанятый электронный уровень с более высокой энергией, совершается соответствующий электронный переход, и атом оказывается в так называемом возбужденном состоянии. Возбужденное состояние атома неустойчиво, и рано или поздно электрон вновь возвратится на свою основную орбиту, а атом потеряет приобретенную энергию, испуская фотон (рис. 1).
Рис. Диаграмма электронных переходов между различными энергетическими
уровнями при поглощении и излучении света
Итак, энергия излучения (фотона) равна разности энергетических уровней двух электронных орбит, между которыми произошел переход, и, как мы уже говорили, эта величина зависит от природы атома. За исключением металлов, составляющих первую группу периодической системы, все атомы обладают несколькими валентными электронами, расположенными, как правило, на нескольких валентных электронных орбитах (уровнях). Таким образом, для переходов валентных электронов может быть использовано несколько орбит, и в зависимости от того, на какой энергетический уровень выйдет электрон при переходе атома в возбужденное состояние, меняется и энергия фотона, испускаемого при возвращении атома в основное состояние.
Поэтому атом характеризуется не одной полосой испускания, а набором (спектром) этих полос.
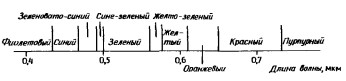
Энергия фотонов и длина волны излучаемого света связаны обратной пропорциональной зависимостью: чем выше энергия излучения, тем меньше длина волны. При переходах валентных электронов испускаются фотоны с длинами волн, соответствующими электромагнитному излучению в видимой или ультрафиолетовой области спектра. Длину волны, то есть энергию, излучения в видимой области можно оценить по получающейся окраске (рис. 2).
Рис. 2. Видимая область спектра
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.