Триумф и драма Фридриха Кекуле
Формула бензола сегодня известна каждому химику, однако, вполне естественно, было время, когда химики о строении бензола ничего не знали. Впервые бензол выделил М. Фарадей в 1825 г. из жидкого конденсата светильного газа. В лаборатории его синтезировал Э. Мичерлих в 1833 г. термическим разложением бензольной кислоты. Оба факта вошли в историю химии как малозаметные события, зато момент, когда было установлено строение бензола, считается крупной вехой. В 1865 г. появляется предложенная Фридрихом Кекуле знаменитая формула бензола, ставшая на долгое время эмблемой органической химии. В 1965 г. вся мировая химическая общественность отмечала столетие этого события.
Здесь невольно хочется отметить, что общую картину творчества ученых всегда умело приукрашивали биографы и журналисты, желающие угодить вкусам читателей и старающиеся преподнести сам факт открытия с рекламной яркостью. Момент, когда было установлено строение бензола, также окутан легендами. Существует версия, будто бы Фридрих Кекуле увидел в руках своего учителя Ю. Либиха перстень графини Герлиц, который служил уликой в судебном процессе, где Либих участвовал в качестве эксперта. Перстень представлял собой двух сплетенных змей из золота и платины. Задремав у камина (крупные открытия, как любят отмечать журналисты, почему-то часто совершаются во сне) Фридрих Кекуле увидел этот перстень, а затем кольцевую формулу бензола в виде двух змей, кусающих друг друга за хвост. По другой версии ему привиделись шесть обезьян, соединенных в кольцо сплетенными хвостами (простые связи) и держащих друг друга за лапы (двойные связи). Есть свидетельства, что формулу бензола: подсказал ему узор персидского ковра, лежащего у камина.
Можно предположить, что Фридрих Кекуле изобретательно подшучивал над журналистами. Ученые прошлых лет (так же, впрочем, как и в наши дни) не испытывали особого желания подробно объяснять настойчивым и нетерпеливым журналистам весь путь, ведущий к открытию. Проще было сообщить яркую, но ничего не объясняющую деталь.
Трудно возражать против того, что решение какой-либо проблемы может быть найдено во сне, но спать ложатся все люди, почему же формула бензола привиделась именно Кекуле, а не кому-нибудь другому? Какие размышления предшествовали этому событию? Истинная история прозаичная, но, с точки зрения химика, гораздо более интересная. Глядя на формулу бензола, мы можем определенно сказать, что это молекула циклическая и что атомы углерода в ней равноценны, чаще говорят, эквивалентны. Под словом «эквивалентны» подразумевается следующее: каждый атом углерода связан с одним атомом водорода и двумя атомами углерода, причем с одним из соседних атомов углерода простой связью, а с другим — двойной, иными словами, каждый атом углерода имеет строго одинаковое окружение.
Почему же Кекуле считал, что молекула циклическая? Это легко доказать, если провести каталитическое гидрирование бензола по схеме:
С6Н6 + 3Н2 = С6Н12
то образуется циклогексан, циклическое строение которого было установлено ранее. Теперь попробуем доказать, что все атомы углерода эквивалентны. Вначале проведем бромирование и получим монобромбензол С6Н5Вr:
C6H6 + Br2 = C6H5Br + HBr
Исследования показали, что при замещении только одного атома водорода на бром образуется одно индивидуальное соединение и нет изомеров(напомним, что изомерами называют вещества, у которых одинаковый состав, но разное строение). Итак, это первое указание на то, что все шесть атомов углерода в цикле одинаковы. Дополнительное подтверждение выглядит следующим образом. Вначале из бромбензола получим натриевую соль бензойной кислоты:
C6H5Br + Na2CO3 = C6H5COONa + NaBr
Далее из этой натриевой соли получим бензойную кислоту, которую затем бромируем:
C6H5COONa + HCl = C6H5COOH + NaCl
C6H5COOH + Br2 = Br-C6H4-COOH + HBr
Очевидно, что новый атом брома присоединится к другому атому углерода, т. е. не к тому, к которому был присоединен первый атом, так как на месте первого атома брома находится карбоксильная группа. При нагревании полученной бромбензойной кислоты в присутствии щелочи отщепляется диоксид углерода и образуется бромбензол:
Br-C6H4-COOH → C6H5Br + CO2
Мы уже отметили, что во вновь полученном бромбензоле атом брома присоединен не к тому атому углерода, к которому был присоединен в исходном бромбензоле. Однако по свойствам это вновь полученное соединение ничем не отличается от исходного, следовательно, атомы углерода в бензоле равноценны.
Отвлечемся на время от химической стороны вопроса, проверим, не нарушили ли мы логику в наших рассуждениях. Строго говоря, мы доказали эквивалентность только двух атомов углерода, тех, к которым вначале и в конце нашей схемы был присоединен бром. А как же решить вопрос с остальными четырьмя атомами? Вопрос важный, так как иначе нельзя считать задачу до конца решенной. Дело в том, что как при введении первого атома брома, так и при введении второго существует возможность того, что будут задействованы разные углеродные атомы бензольного кольца. Если бы два атома углерода были равноценны, а остальные нет, то мы обязательно получили бы смесь разных бромбензолов.
Приведенное доказательство эквивалентности атомов несколько громоздко, не так ли? Современные спектроскопические методы позволяют ответить на тот же самый вопрос практически за минуту, однако это никак не снимает необходимости найти правильное объяснение с помощью рассуждений.
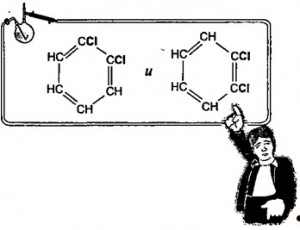
Итак, в предполагаемой формуле бензола требовалось объединить полученные сведения: циклическое строение, эквивалентность атомов углерода, и четырехвалентность углерода (которая для органических соединений была установлена несколько ранее). Кекуле превосходно решил эту задачу, предложив теперь уже хорошо знакомую нам формулу. Полного триумфа все же не получилось, формула бензола преподнесла своему создателю неприятный сюрприз. Исследователи сразу заметили, что в соответствии с предложенной формулой должно существовать два различных орто-замещенных бензола (приставка «орто» означает, что замещающие атомы присоединены к соседним атомам углерода), например, два орто-дихлорбензола:
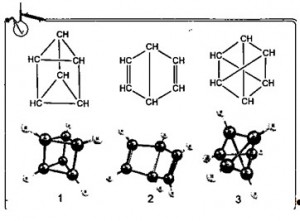
В первом случае атомы хлора находятся у атомов углерода, связанных простой связью, а во втором — двойной. Тем не менее исследования показали, что не существует двух различных орто-дихлорлорбензолов. Есть только один. Ситуация сложилась поистине драматическая, возникли серьезные сомнения в правильности предложенной формулы. Несовершенство структуры, предложенной Кекуле, привело к тому, что стали появляться другие варианты:
Структура 1 была предложена Ладенбургом, 2 — Дьюаром, 3 — Клаусом. Рассмотрим показанные структуры внимательнее. Каждая соответствует брутто-формуле С6Н6, и всюду четырехвалентность углерода соблюдается. Тем не менее все они в меньшей степени согласуются с экспериментальными данными, нежели формула Кекуле. Структура 1 не циклическая, у соединения 2 атомы углерода неравноценны. Вариант 3 может быть легко изображен на плоском рисунке, но при попытке представить его в пространстве возникают серьезные трудности, что вызывает сомнения в реальности такой конструкции.
Судьба показанных выше структур по-своему примечательна, две из них (1 и 2) удалось получить лишь во второй половине XX века, их назвали бензолом Ладенбурга и бензолом Дьюара соответственно. Маловероятно, что структура 3 будет когда-нибудь получена.
В поисках способа, позволяющего улучшить предложенную структуру, Кекуле обратил внимание на то, что двойные связи бензольного кольца по своему химическому поведению заметно отличаются от двойных связей, например в этилене. Для бензола наиболее типичны реакции замещения атомов водорода присоединение по кратным связям проходит с большим трудом, а в случае этилена оно протекает легко. В результате Кекуле делает очень смелое предположение: двойные связи присутствуют, но они несколько необычные — их положение не фиксировано, и они «осциллируют», т. е. колеблются, меняя пару соединяемых атомов углерода (маловероятно, что эта оригинальная идея явилась автору тоже во сне, а не в результате напряженных размышлений). Таким образом, удалось объяснить, почему нет изомеров у орто-дихлорбензола. На первый взгляд может показаться, что автор изобретательно пытался спасти свою формулу. На самом деле это был смелый шаг почти на сто лет вперед.
В пятидесятые годы XX столетия крупный американский химик Лайнус Полинг, разрабатывая представления о природе химической связи, формулирует известную в свое время «теорию резонанса».
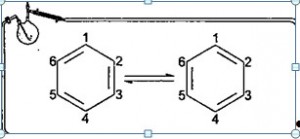
В основу положено утверждение, что строение некоторых веществ описывается не одной структурной формулой, а неким набором резонирующих структур. Для бензола он предложил практически то, что в свое время предполагал Кекуле (атомы углерода пронумерованы для того, чтобы можно было отчетливо заметить перемещение двойных связей):
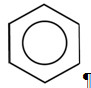
К настоящему моменту теория резонанса считается устаревшей, по современным представлениям положение электронов в двойных связях не фиксировано, они образуют единое замкнутое электронное кольцо. В современной формуле это обозначают, рисуя кольцо символом внутри цикла:
Интересно, что современные исследования не отменили прежнюю формулу, а только ее скорректировали. Старую формулу, предложенную Кекуле, до сих пор считают правильной, и ее можно часто увидеть в научных работах.
Отзывов (23) на «Триумф и драма Фридриха Кекуле»
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
06 Ноя 2011 в 12:44
Серьезная статья
06 Ноя 2011 в 15:24
Приветствую своего коллегу: я ведь тоже химик. Отличная статья: всё очень подробно, доходчиво. Так держать!
06 Ноя 2011 в 15:25
А почему Вы не написали про SP3-гибридизацию?
06 Ноя 2011 в 15:27
от чего же я химию то забросил в 9 классе?
06 Ноя 2011 в 16:08
Спасибо за обзор! Успехов!
06 Ноя 2011 в 16:32
я обожал химию в школе! но… как только началась органическая химия, я напрочь перестал ее понимать :))
06 Ноя 2011 в 17:09
Я в химии мало что соображаю, но спасибо за статью.
06 Ноя 2011 в 17:12
Спасибо за статью, прочитал с интересом.
06 Ноя 2011 в 17:27
Спасибо, очень интересно! Вспомнилась школа))
06 Ноя 2011 в 18:45
У Вас специфичная информация!
06 Ноя 2011 в 18:55
Человеческий пытливый «мозг» не может «сидеть» сложа руки(извилины). Обезательно. что-то придумает!
06 Ноя 2011 в 18:58
Интересная и познавательная статья.
06 Ноя 2011 в 19:30
Ничего в этом не понимаю, но наверное это кому-то интересно.
06 Ноя 2011 в 19:49
прямо как на уроке моей любимой химии побывала! 0
благодарю! Не нашла, правда, ни одного выделенного слова, что бы повторить ключевое для статьи! )
06 Ноя 2011 в 20:14
Интересно и познавательно.
06 Ноя 2011 в 20:41
Очень интересная и серьезная тема. Считаю, что такая серьезная тема будет не для всех понятна. Но что делать, знания просто так не даются. Нужно учиться и учиться.
06 Ноя 2011 в 21:37
Никогда не слышал об этом ученом. Спасибо!
06 Ноя 2011 в 21:47
Спасибо,познавательная статья.
06 Ноя 2011 в 22:04
А я сразу вспомнила студенческие годы, когда изучала не просто химию, а все химии подряд: органическую, неорганическую, коллоидную и т.д., и т.п., но по специальности к сожалению не работаю.
Спасибо за статью, с большим интересом прочитала и вспомнила, что у меня есть диплом и я инженер-технолог-химик ППМ и ИК.
06 Ноя 2011 в 22:28
Пришлось вспомнить то ,что когда то учил в институте ,лет 30 назад.Познавательная статья,спасибо!
06 Ноя 2011 в 22:30
Спасибо. Ваш сайт очень интересен.Вы помогаете мне блеснуть эрудицией перед внуками.
06 Ноя 2011 в 22:52
большое спасибо за такую статью. очень!
человеческим языком про химию! ура — все поняла
06 Ноя 2011 в 22:57
Сразу вспомнилась школа! Спасибо за статью.