Метод нейтрализации как способ технического анализа
Т. Бергман, А. Л. Лавуазье и другие исследователи XVIII в. создавали гравиметрический анализ без явных утилитарных целей − анализ был инструментом фундаментальных исследований, средством познания природы. В частности, гравиметрия стала способом изучения состава минералов и органических веществ, а также способом изучения химических процессов. Конечно, эта цель не исключала применения гравиметрии для аналитического контроля конкретных производств (например, металлургического). Однако гравиметрия, особенно метод осаждения, всегда была слишком продолжительна и трудоемка чтобы ее можно было эффективно использовать в заводских лабораториях. В руководстве по анализу минералов В. Лампадиуса (1801) указывалось, что те, кто не может ждать результатов неделями и месяцами, не должны приступать к аналитической работе. Лампадиус имел в виду именно гравиметрический анализ.
Однако производство в отличие от фундаментальной науки не может ждать неделями и месяцами. Для химических и металлургических производств, для обеспечения повседневных нужд торговли и медицины требовались иные методы количественного анализа. Подходящий метод — объемный анализ — был изобретен во Франции, что вполне закономерно. Для французской науки всегда была характерна связь с практикой, и такая связь стала особенно тесной в годы промышленной революции, т.е. в конце XVIII в. и в первой половине XIX в.
Обычно считается, что титриметрический (объемный) анализ создан французским химиком Ж. Гей-Люссаком в 20-30-е гг. XIX в. Такое утверждение можно найти во многих отечественных и зарубежных учебниках. Однако на самом деле это не так. Ж. Гей-Люссак внес большой вклад в развитие титриметрии, да и само это название предложено именно им, но принципы титриметрии разработаны другими учеными. Задолго до Ж. Гей-Люссака методики титриметрического анализа уже применяли в разных странах, особенно во Франции, как в заводских, так и в научных лабораториях.
Титриметрический анализ возник как метод нейтрализации, другие реакции стали использовать несколько позже. Представления о нейтрализации кислот веществами щелочного характера (содой, поташом) имели еще алхимики. Позднее ятрохимики Я. Б. Ван Гельмонт и О. Тахений указывали, что кислоты и щелочи должны реагировать в определенном количественном соотношении, причем в этой реакции образуются растворимые соли. И. Глаубер в начале XVII в. применил реакцию нейтрализации в производстве химических реактивов. Для приготовления селитры он добавлял к азотной кислоте раствор поташа (карбоната калия) до тех пор, пока «оба вещества не лишатся своих враждебных характеристик и не убьют друг друга». Точку нейтрализации И. Глаубер замечал по прекращению выделения пузырьков углекислого газа при добавлении очередной капли раствора поташа.
Нейтрализацию кислот «щелочами» (содой или поташом) в присутствии природных цветных индикаторов изучал Р. Бойль. В 1663 г. он писал, что голубая окраска его индикатора исчезает при добавлении кислоты, но он может восстановить ее, добавляя раствор «щелочи» (соды или поташа). Можно даже судить о «крепости» раствора кислоты по количеству раствора щелочи, которое понадобится для восстановления голубой окраски индикатора. В 1699 г. ученик Р. Бойля, французский химик В. Гомберг попытался использовать найденные таким способом «соотношения сродства» для количественного определения содержания кислот в водных растворах, но не довел эти исследования до конца.
Историки химии выделяют работы Клода Жоффруа (1726), который впервые применил реакцию нейтрализации для оценки качества промышленной продукции (уксуса). Однако ни К. Жоффруа, ни другие французские исследователи, использовавшие в начале XVIII в. реакции нейтрализации, не могут, строго говоря, считаться основателями объемного анализа, так как они измеряли в качестве аналитического сигнала не объем стандартного раствора щелочи, а массу твердого щелочного реагента (поташа или соды). Контролировали процесс по выделению пузырьков газа, вблизи точки насыщения выделение газа прекращалось. По-видимому, объем раствора титранта, затрачиваемого на нейтрализацию исследуемого раствора, впервые стал измерять немецкий аналитик Каспар Нейман (1727), но детали его работы историкам неизвестны. Больший интерес современников вызвала работа шотландца Ф. Хоума (1756), который применял ту же реакцию, что и К. Нейман, а измерял объем титранта (водного раствора кислоты) чайными ложками. Он указывал, что при добавлении каждой порции титранта начиналось бурное, но недолгое выделение газа. Позднее российский исследователь Т. Е.Ловиц проводил титрование уксусной кислоты, добавляя к ней титрант (тарт-рат калия) по каплям, а результат анализа рассчитывал по числу добавленных капель.
Более основательными были исследования У. Льюиса (1767), который определял точку эквивалентности («точку насыщения») не по прекращению выделения газа, а с помощью цветных индикаторов или бумаги, пропитанной этими индикаторами. Для большей точности У. Льюис предлагал измерять не объем, а массу раствора кислоты, затраченного на нейтрализацию пробы. Такие методики вскоре были использованы и для анализа смесей кислот, например соляной и азотной (Гитон де Морво).
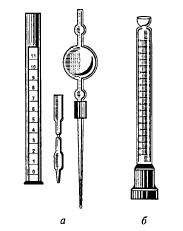
Особое значение для развития объемного анализа имели работы французского изобретателя и химика-технолога Ф. Декруазиля (1751-1825), который ввел в употребление мерные пипетки, мерные колбы с тонкой шейкой и, что наиболее важно, изобрел бюретку с делениями (а также огнетушитель, кофеварку и многие другие полезные вещи). Хотя крана на бюретке Декруазиля не было, скорость вытекания из нее титранта можно было регулировать (рис.). Ф. Декруазиль в 1806 г. разработал и опубликовал методики прямого кислотно-основного титрования с применением цветных индикаторов при точном измерении объема титранта. Методики Декруазиля были весьма сходны с современными, но они не были нацелены на определение концентрации растворов или процентного содержания кислот (или щелочей) в технических продуктах. Оценивали качество продуктов, причем в условных единицах — градусах. Так, если расход кислоты на единицу массы поташа был меньше некоторого критического значения, исследуемый поташ считался недостаточно качественным. Не ясно было только, какой именно природный индикатор лучше использовать в том или ином случае.
Очевидно, чтобы титриметрия из метода технического контроля стала универсальным аналитическим методом, пригодным Даже для научных исследований, надо было разработать теоретические представления об эквивалентах и соответствующие способы расчетов. Отметим, что сами значения эквивалентов были получены И. Рихтером (1800) не только весовым, но и объемным методом.
Английский исследователь Дж. Блэк в 1800-1810 гг. существенно расширил возможности метода нейтрализации: он впервые провел обратное титрование щелочей, добавляя к пробе избыток кислоты и оттитровывая непрореагировавшую кислоту раствором карбоната калия. Дж. Блэк также предложил при подготовке растворов кислот или щелочей заранее удалять растворенный в воде углекислый газ, предотвращая соответствующие погрешности анализа. Кроме того, он вносил поправку на тот объем титранта, который расходуется на изменение окраски индикатора в холостом опыте. После работ Ф. Декруазиля и Дж. Блэка принципиальных изменений метода нейтрализации не было в течение нескольких десятилетий. Можно отметить лишь введение новых титрантов — вместо ранее применявшихся растворов поташа и соды с 1846 г. стали применять растворы гидроксидов натрия или калия (А. Бино). Эти реагенты давали более четкий переход окраски цветных индикаторов. А. Бино разработал также остроумный способ титриметрического определения азота в органических веществах, основанный на переводе его в аммиак, отгонке аммиака, поглощении его кислотой и последующем титровании не прореагировавшей кислоты стандартным раствором щелочи. Позднее (1883) этот важнейший аналитический метод определения азота был усовершенствован И. Кьельдалем и с тех пор носит его имя.
В последней четверти прошлого века в Германии был разработан целый ряд синтетических кислотно-основных индикаторов.
Рис. Устройства для титрования:
а — первый набор приборов (1795); б — бюретка Декруазиля (1806)
Первым из них в титриметрии начали применять одноцветный фенолфталеин (П. Лук, 1877). Чуть позже (1878) Георг Лунге синтезировал и исследовал двухцветный метиловый оранжевый, а также некоторые его аналоги. С того времени новые кислотно-основные индикаторы появлялись и испытывались в анализе почти ежегодно.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.