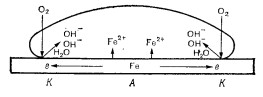
Коррозия железа при неравномерной аэрации (доступ воздуха)
При неравномерной аэрации на поверхности металла образуется гальваническая пара особого вида. Участки металла, куда поступает кислород, будут катодами, а участки, к которым доступ кислорода затруднен ‒ анодами. Наблюдают это за образованием характерной окраски.
Железную пластинку очищают наждаком, промывают, высушивают фильтровальной бумагой: Еще лучше по верхней части ее протравить в 10-процентном растворе соляной кислоты.
На чистую поверхность наносят каплю реактива (100 мл 3-процентного раствора хлорида натрия, в который добавлено 0,5 мл 1-процентного свежеприготовленного раствора железо-цианистого калия К3[Fе(СN)6] и несколько капель 1-процентного спиртового раствора фенолфталеина). Наблюдают явления, которые происходят под каплей раствора, учитывая, что участок металла, которая ближе к внешней части капли, лучше снабжается кислородом и выполняет роль катода. В центре капли доступ кислорода к металлу затруднен. Этот участок выполняет роль анода (рис.).
Рис. Коррозия металла под каплей раствора электролита при различной аэрации
Через несколько минут появляется синяя окраска на поверхности металла в центре капли, по краям капли ‒ розовое кольцо. Через некоторое время перед розовым кольцом, ближе к центру капли, появляется бурое кольцо.
Коррозия железа (окисления атомов железа в ионы Fе2+) ‒ процесс, который происходит на анодном участке: FеО → Fе2+ + 2e—. Электроны перемещаются в металле к внешним краям капли (к катоду). Образовавшийся синий осадок турнбулевой сини ‒ результат качественной реакции на ион Fе2+:
3Fе2+ + 2[Fе(СN)6]3- = Fе3[Fе(СN)6]2.
На катоде восстанавливается кислород:
2Н2O + O2 + 4e— = 4OН—.
Ионы Fе2+ диффундируют в растворе от центра к внешним краям капли, гидроксильные ионы движутся в обратном направлении. В месте их встречи образуется малорастворимых гидроксид железа Fe(OH)2, который при взаимодействии с кислородом в присутствии влаги переходит в бурый осадок гидроксида железа Fe(ОН)3:
4Fе(ОН)2 + 2Н2O + O2 = 4Fе(ОН)3.
Этот опыт позволяет правильно понять процесс ржавления железа, при котором разрушается металл, прежде всего, в углублениях, куда плохо проникает воздух, а места, куда поступает кислород ‒ не испытывают коррозии.
Реактивы и оборудование: хлорид натрия NaС1, железо-цианистый калий К3[Fе(СN)6]; спиртовой раствор фенолфталеина; железная (стальная) пластинка, наждачная и фильтровальную бумагу.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.