Электролиз воды
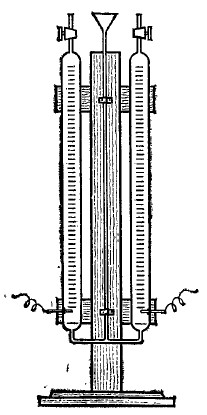
Электролиз воды. 1. Воду можно разложить с помощью электрического тока в аппарате Гофмана с платиновыми электродами или в аппарате такой же конструкции, но с никелевыми или медными электродами (рис. 1).
Рис. 1. Аппарат конструкции Гофмана
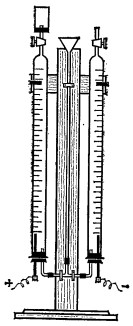
Если в школе нет такого прибора, ученики сами могут изготовить аналогичный по конструкции к аппарату Гофмана. На рис. 2 изображен такой прибор.
Рис. 2. Самодельный прибор, аналогичный по конструкции
к аппарату Гофмана
Через лепку в бюретки, в которых открыты краны, наливают 5‒10-процентный раствор серной кислоты. Воду подкисляют серной кислотой для того, чтобы увеличить электропроводность. Прибор включают в источник постоянного тока напряжением 10-12 В.
Чтобы убедиться, что на катоде выделяется водород, а на аноде кислород, объем водорода, который выделился, в два раза больше объема кислорода, осторожно открывают краны бюретки. К отверстию бюретки, в которой объем газа в два раза больше, подносят зажженную спичку. Газ вспыхивает с характерным для водорода звуком и спокойно сгорает, образуя капельки воды на холодном предмете, если его осторожно внести в пламя. Кислород во второй бюретке определяют, пользуясь широкой стеклянной трубкой, которую насаживают на бюретку с помощью пробки. Тлеющая лучина загорается, если ее внести в трубку, в которую выходит газ.
Реактивы и оборудование: серная кислота Н2SO4, две бюретки с кранами емкостью 25 мл, стеклянная тройник, лейка, несколько отрезков резиновых и стеклянных трубок, никелевые или медные пластинки, пробки, лучина, источник постоянного тока или выпрямитель, штатив.
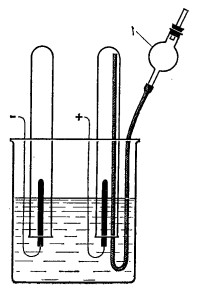
2. Состав воды можно определить электролизом с помощью простого прибора (рис. 3).
Рис. 3. Прибор для демонстрации электролиза воды
В стакан емкостью 500 мл наливают до половины высоты 5-10-процентного раствора серной кислоты и погружают в него две перевернутые вверх дном пробирки, их заполняют раствором электролита так: в пробирку вставляют резиновую трубку, соединенную с хлоркальциевою трубкою, которая выполняет роль предохранителя.
Втягивая в себя воздух, засасывают раствор в пробирку. Предохранитель гарантирует безопасность эксперимента.
В пробирки вставляют электроды (медный катод, железный анод), которые соединяют медными проволоками с источником постоянного тока. Пробирки закрепляют в штативе. Чтобы убедиться, что в одной пробирке водород, ее подносят к пламени и наблюдают характерное воспламенения. Кислород во второй пробирке выявляют с помощью тлеющей лучины.
Чтобы определить объемное соотношение добытых газов, пробирки надо проградуировать. Для этого в сухую пробирку наливают 1 мл воды, черточкой на стекле отмечают уровень воды в пробирке. Затем доливают еще 1 мл воды и отмечают черточкой. Так градуируют обе пробирки. Вместо пробирок можно использовать бюретки.
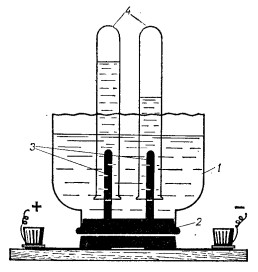
3. С такой же целью можно использовать прибор, изображенный на рис. 4.
Рис. 4. Прибор для демонстрации электролиза воды
Как электролизер используют банка с отрезанным дном, банку закрывают пробкой 2, в которой неподвижно закреплен электроды 3.
Чтобы увеличить электропроводность воды, вместо серной кислоты в воду добавляют другие электролиты (едкий натр, карбонат натрия).
Если надо точно определить соотношение между объемами газов, выделяемых в результате электролиза, лучше не пользоваться угольными электродами, ибо через адсорбцию водорода углем результаты будут неточными.
Отклонения от предусмотренных результатов возможно также вследствие неодинаковой растворимости водорода и кислорода в воде. Поэтому, используя прибор конструкции, подобной аппарата Гофмана, включают его на 5-10 мин при открытых кранах для насыщения электролита газами, которые выделяются в результате электролиза.
Реактивы и оборудование: серная кислота Н2SO4; стеклянный стакан емкостью 500 мл, две пробирки, два железные гвозди, медные проводники, штатив, источник постоянного тока.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.