Электрохимические процессы
Все электрохимические процессы можно разделить на две противоположные группы: процессы электролиза, при которых под действием внешнего источника электроэнергии происходят химические реакции, и процессы возникновения электродвижущей силы и электрического тока вследствие определенных химических реакций.
В первой группе процессов электрическая энергия превращается в химическую, во второй ‒ наоборот, химическая ‒ в электрическую.
Примерами процессов обоих типов могут быть процессы, происходящие в аккумуляторах. Так, при работе свинцового аккумулятора генератора электрической энергии происходит реакция:
Рb + РbO2 + 4Н+ + 2SO42- → РbSO4 + 2Н2O.
Вследствие этой реакции освобождается энергия, которая и превращается в электрическую. Когда аккумулятор разрядится, его заряжают, пропуская через него электрический ток в обратном направлении.
В обратном направлении протекает и химическая реакция:
2РbSO4 + 2Н2O → Рb + РbO2 + 4Н+ + 2SO42-.
В этом случае электрическая энергия превратилась в химическую. Теперь аккумулятор снова имеет запас энергии и снова может разряжаться.
Все электрохимические реакции происходят при протекании электрического тока в цепи. Этот круг обязательно состоит из последовательно соединенных металлических проводников и раствора (или расплава) электролита. В металлических проводниках, как мы знаем, ток переносят электроны, в растворе электролитов ‒ ионы. Непрерывность протекания тока в цепи обеспечивается только тогда, когда происходят процессы на электродах, т.е. на границе металл ‒ электролит На одном электроде происходит процесс приема электронов ‒ восстановление, на втором электроде — процесс отдачи электронов, т.е. окисления.
Особенностью электрохимических процессов, в отличие от обычных химических, является пространственное разделение процессов окисления и восстановления. Из этих процессов, которые не могут происходить друг без друга, и состоит в целом химический процесс в электрохимической системе.
Если погрузить металлическую пластинку (электрод) в раствор электролита, то между пластинкой и раствором возникает разность потенциалов, которая называется электродного потенциала.
Рассмотрим причины его возникновения. В узлах кристаллической решетки металла содержатся только положительно заряженные ионы. Благодаря их взаимодействию с полярными молекулами растворителя, они отрываются от кристалла и переходят в раствор. Вследствие такого перехода в металлической пластинке остается избыток электронов, отчего она приобретает отрицательный заряд. Положительно заряженные ионы, которые перешли в раствор благодаря электростатическому притяжению, остаются непосредственно у поверхности металлического электрода. Образуется двойной электрический слой. Между электродом и раствором возникает скачок потенциала, который и называется электродным потенциалом.
Наряду с переходом ионов из металла в раствор происходить и обратный процесс. Скорость перехода ионов из металла в раствор V1 может быть больше скорость обратного перехода ионов из раствора в металл V2 (V2 ˃ V1).
Такая разница в скоростях приведет в результате к уменьшению количества положительных ионов в металле и увеличению их в растворе. Металлический электрод приобретает отрицательный заряд, раствор ‒ положительного.
Чем больше разница V1‒V2, тем более негативным будет заряд металлического электрода. В свою очередь величина V2 зависит от содержания ионов металла в растворе; большим их концентрациям соответствует большая скорость V2. Следовательно, с увеличением концентрации ионов в растворе уменьшается отрицательный заряд металлического электрода.
Если, наоборот, скорость перехода ионов металла в раствор будет меньше скорость обратного процесса (V1 < V2), то на металлическом электроде будет избыток положительных ионов, а в растворе ‒ их нехватка. В таком случае электрод вступит положительный заряд, а раствор ‒ негативного.
В обоих случаях разность потенциалов, которая возникает в результате неравномерного распределения зарядов, ускорять медленный процесс и тормозить быстрее. Вследствие этого наступит момент, когда скорости обоих процессов станут равными. Наступит равновесие, которое будет иметь динамичный характер. Переход ионов из металла в раствор и обратно будет происходить все время и в состоянии равновесия. Скорости этих процессов в состоянии равновесия будут одинаковыми (V1p = V2p). Величина электродного потенциала, которая хранится в состоянии равновесия, называется равновесным электродным потенциалом.
Потенциал, который возникнет между металлом и раствором, если погрузить металл в раствор, в котором концентрация ионов этого металла равна одному грамм-иона, называться нормальным или стандартным электродным потенциалом.
Если разместить нормальные потенциалы электродных реакций для различных металлов так, чтобы их алгебраические величины последовательно росли, то мы получим известный из общего курса химии ряд напряжений. В этом ряду все элементы размещены в зависимости от их электрохимических свойств, которые непосредственно связаны с химическими свойствами. Так, все металлы расположены в меди (т.е. с более негативными потенциалами), относительно легко окисляются, а все металлы, размещенные после меди, окисляются с достаточно большими трудностями.
К, Na, Са, Мg, А1, Мn, Zn, Fe,
Ni, Sn, Pb, Н2, Сu, Нg, Аg, Аu.
Каждый член ряда, как более активный, может вытеснять из соединений любого члена ряда, стоящего вправо от него в ряду напряжений.
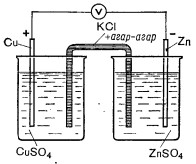
Рассмотрим механизм действия гальванического элемента, схему которого представлен на рис. Элемент состоит из цинковой пластинки, погруженной в раствор сульфата цинка, и медной пластинки, погруженной в раствор сульфата меди.
Рис. Схема медно-цинкового гальванического элемента
Оба сосуды с растворами, которые называются полуэлементами, соединенные между собой электролитическим ключом в гальванический элемент. Этот ключ (стеклянная трубка, заполненная электролитом) позволяет ионам перемещаться из одного сосуда (полуэлемента) в другую. Вместе растворы сульфата цинка и сульфата меди не смешиваются.
Если электрическая цепь разомкнутое, то никаких изменений в металлических пластинках и в растворе не происходит, а когда замкнуть круг, то по кругу потечет ток. Электроны из места, где плотность отрицательного заряда выше (т.е. с цинковой пластинки), перемещаться в места с меньшей плотностью отрицательного заряда или к месту с положительным зарядом (т.е. к медной пластинки). Вследствие перемещения электронов равновесие на границе металл ‒ раствор нарушится. Избыток отрицательных зарядов в цинковой пластинке уменьшится, соответственно уменьшатся силы притяжения, и часть ионов цинка из двойного электрического слоя перейдет в общий объем раствора. Это приведет к уменьшению скорости процесса перехода ионов Zn2+ из раствора в металл. Увеличится разница V1‒V2 (которая в состоянии равновесия равна нулю), и новое количество ионов цинка перейдет из металла в раствор. Это обусловит появление избытка электронов в цинковой пластинке, которые немедленно переместятся к медной пластинки, и опять все будет непрерывно повторяться. Вследствие этого цинк растворяться, а в кругу непрерывно протекать электрический ток.
Понятно, что непрерывное перемещение электронов от цинковой пластинки к медной возможно только тогда, когда они асимилируют на медной пластинке. Появление избытка электронов в медной пластинке приведет к перестройке двойного слоя. Отрицательные ионы SO42-отталкиваться, а положительные ионы меди, которые есть в растворе, будут заходить в двойной электрический слой благодаря электростатическому притяжению, обусловленном появлением электронов. Скорость процесса перехода ионов в металлV2 увеличится. Ионы Сu2+ проникать в кристаллическую решетку медной пластинки, присоединяя электроны. Именно этот процесс ассимиляции электронов на медной пластинке обеспечит непрерывность процесса в целом.
Величина ЭДС Е равна разности электродных потенциалов Е1 и Е2 на электродах: Е = Е1‒Е2.
Процессы, которые происходят на электродах, можно изобразить схемой: на грани цинковая пластинка ‒ электролит Zn ‒ 2е— = Zn2+, на грани медная пластинка электролит Сu2+ + 2е— = Сu.
Как видим, процессы окисления цинка и восстановление меди разделены в пространстве, они происходят на разных электродах. В целом химическую реакцию, которая происходит в медно-цинковом элементе, можно записать в ионной форме так:
Zn + Сu2+ = Zn2+ + Сu.
Такая же картина будет наблюдаться и в том случае, когда обе пластинки будут заряжены отрицательно относительно раствора. Погрузим две медные пластинки в разбавленные растворы сульфата меди. Концентрация ионов меди в этих растворах С1 и С2 (С2 > С1). Предположим, что обе пластинки зарядятся негативно относительно растворов. Но пластинка А в сосуде с концентрацией раствора С1 зарядится более негативно благодаря тому, что концентрация ионов меди в этом сосуде меньше, чем во второй сосуде, и соответственно скорость проникновения ионов Сu2+ в кристаллическую решетку будет меньше. Если замкнуть круг, то электроны будут перемещаться от пластинки А, где их плотность больше, к пластинке В. На грани пластинки А с электролитом происходить процесс Сu° ‒ 2е— = Сu2+, на грани пластинки В с электролитом Сu2+ + 2е— + Сu°.
Обе пластинки, как было уже отмечено, заряжены отрицательно относительно раствора. Но пластинка А заряжена отрицательно относительно пластинки В и поэтому в гальваническом элементе выполнять роль отрицательного электрода, а пластинка В ‒ положительного.
Величина ЭДС, равной разности электродных потенциалов, будет тем больше, чем больше разница концентраций ионов в растворах.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.