Типы химической связи
Еще в прошлом веке появилась идея о том, что атомы соединяются в молекулы под влиянием некоего гипотетического химического сродства, которое получило название валентности. В то время наука не располагала еще многими физическими приборами, и смысл этих терминов долгое время оставался неясным. В самом деле, ведь на основе массовых соотношений между элементами в химических соединениях нельзя было подсчитывать, какую валентность проявляет один атом, объединяясь с другим. Химики прошлого столетия не могли понять физический смысл сил, связывающих между собой атомы, и поэтому так трудно было разобраться во многих экспериментальных фактах, в частности в существовании элементов, соединяющихся с одним и тем же элементом в различных массовых соотношениях, то есть, как теперь говорят, проявляющих переменную валентность. В качестве примера можно привести серу, валентность которой может быть равна 2, 4 или 6. Тем не менее, чтобы дать хоть какое-то, пусть и формальное, понятие о валентности, при изображении молекул между отдельными атомами связи стали показывать в виде черточек.
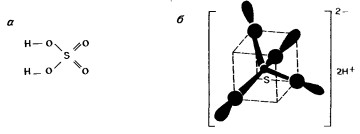
Типы химической связи. Современные представления о химической связи основаны на знании электронной структуры молекулы. Но очень часто для изображения молекул продолжают использовать эти традиционные «структурные» формулы, то есть атомы соединяют между собой черточками, но вкладывают в эти схемы сейчас совершенно иное содержание, чем раньше. Кроме того, все чаще в литературе встречаются и другие изображения, где химические связи показаны в виде электронных облаков (рис. 1).
Рис. 1. Изображение молекулы серной кислоты: а — традиционная структурная формула, б — учет пространственного расположения атомов и схема электронных облаков.
В соответствии с расположением элементов в периодической системе, число электронов, размещенных на внешней электронной оболочке любого атома, равно номеру вертикального столбца, в котором находится этот атом. На внешней электронной оболочке щелочных металлов (I столбец таблицы или, как теперь принято называть эти элементы, I группа) расположены всего один электрон, у щелочноземельных металлов (II группа) два, у галогенов (VII группа) семь и у благородных газов (0 группа) восемь валентных электронов. Обычно наибольшей реакционной способностью отличаются элементы, находящиеся в первой и седьмой группах (вертикальные столбцы), а наименьшей благородные газы, размещенные в нулевой группе. Среди различных вариантов расположения электронов восьми электронная оболочка благородных газов энергетически наиболее выгодна для любого элемента. Вот почему химические реакции обычно протекают в том направлении, которое наиболее благоприятно для того, чтобы участвующие в реакции элементы «достроили» свои оболочки до восьми электронной. Правда, это осуществимо далеко не всегда, и элементы вынуждены зачастую идти на «компромиссы».
Вступая в химические реакции, металлы I и II групп довольно легко отдают свои «лишние» электроны и образуют соответственно одно- и двухзарядные положительные ионы. Столь же легко галогены (VII группа) принимают один электрон и становятся отрицательно заряженными ионами (заряд -1). В результате того что электронные оболочки перестраиваются и приобретают конфигурации оболочек благородных газов, некогда очень реакционно-способные атомы превращаются в достаточно стабильные ионы. Все мы помним, как на школьных уроках учитель осторожно извлекал из банки с керосином кусок металлического натрия, отрезал маленький кусочек этого мягкого металла, бросал его в воду, и на наших глазах проходила бурная реакция: кусочек металла «бегал» по поверхности воды, шипел, выделялся газ (водород). Но вот реакция закончилась, и нет уже необычайно реакционно-способных и неустойчивых на воздухе и в присутствии влаги атомов натрия, а есть стабильные ионы натрия Na+, способные длительное время оставаться без всяких изменений, как, например, ионы натрия в поваренной соли.
Ионные соединения (то есть соединения, построенные из ионов) при кристаллизации сохраняют свои заряды, эти ионы переходят в раствор (например, водный) при растворении. Таким образом, ионы — очень устойчивые частицы и в кристаллах прочно связаны между собой электростатическими силами, но даже при отделении крошечных кусочков такого кристаллического вещества и основной кристалл, и эти кусочки остаются электронейтральными.
Превращение атомов в ионы (пусть, например, это будут положительно заряженные ионы, называемые катионами) с конфигурацией благородного газа сопровождается, однако, не только уменьшением внутренней энергии системы, такая система имеет не скомпенсированный заряд, наличие которого тормозит более глубокое изменение электронного состояния (то есть отщепление следующего электрона). Положительно заряженный ион (катион) удерживает оставшиеся электроны значительно сильнее, чем нейтральный атом. Поэтому, если нейтральный атом содержит на внешней оболочке более двух электронов, легко «избавиться» от них он уже не сможет. Точно так же с появлением дополнительного электрона и превращением атома в отрицательно заряженный ион (анион) возрастала бы сила отталкивания между этим электроном и электронной оболочкой. Именно по этой причине такой атом обычно не может принять сразу больше одного электрона. Все это объясняет, почему электронные орбиты атомов, содержащих от 3 до 6 валентных электронов, не превращаются в стабильные ионы с конфигурацией благородных газов путем простого присоединения или удаления электронов, то есть не образуют ионных связей. Понятно, что и по своей реакционной способности такие атомы сильно уступают атомам, способным легко превращаться в ионы.
Атомы, не образующие ионных связей, соединяются между собой в молекулы по-иному. При сближении каждый из них достраивает свою оболочку до завершенной восьми электронной за счет электронов соседнего атома. Иногда общие электронные оболочки, или, как их называют, молекулярные орбитали, образуют не два, а три или даже большее число атомов. Образование общей электронной оболочки возможно только в том случае, если каждый атом предоставит не менее одного электрона. В конечном счете на внешней оболочке вокруг каждого атома, объединившегося в молекулу, должны находиться все те же восемь электронов. Часть этих электронов находится на общих молекулярных орбиталях, и их называют общими электронами, а часть электронов вращается по орбитам, принадлежащим данному атому, и находится как бы в собственности этого атома.
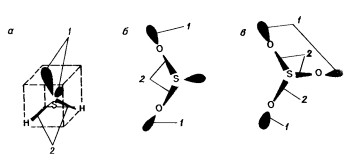
Если воспользоваться полученными сведениями, объяснить существование элементов с переменной валентностью можно тем, что у подобных элементов может меняться соотношение между электронами, размещенными на атомных и молекулярных орбиталях (рис. 2).
Рис. 2. Строение молекул сероводорода (а), диоксида серы (б) и триоксида серы (в). 1 -электроны на атомных орбиталях, 2 — электроны на молекулярных орбиталях.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.